Compuestos orgánicos e inorgánicos

Compuestos orgánicos

Son sustancias químicas que contienen carbono, formando enlaces covalentes carbono-carbono o carbono-hidrógeno
Características
-
Están formados principalmente por carbono (C), hidrógeno (H), oxígeno (O), nitrógeno (N), fósforo (P), azufre (S), flúor (F), cloro (Cl), bromo (Br), yodo (I), entre otros elementos
-
Sus reacciones son lentas y complejas
-
Son inestables al calor
-
Son insolubles en agua
-
Son solubles en contacto con solventes no polares
-
Los compuestos generalmente tienen pesos moleculares altos
-
No conducen corriente eléctrica debido a que no se ionizan
-
Sus puntos de ebullición y de fusión son bajos
-
Generalmente contienen enlaces covalentes
Tipos de compuestos orgánicos según su estructura
Compuestos alifáticos: son los que forman estructuras de cadenas, bien sean lineales o ramificadas
Compuestos aromáticos: son aquellos que forman estructuras de anillos, de las cuales deriva la propiedad de la aromaticidad
Compuestos heterocíclicos: su estructura se forma de anillos de carbono enlazados a otros elementos, como el nitrógeno



Tipos de compuestos orgánicos según sus grupos funcionales
Alcoholes: se forma con un carbono unido a un grupo hidroxilo OH
Éteres: se forman cuando una cadena de carbonos presenta un átomo de oxígeno intercalado
Ésteres: resultan de la combinación de un alcohol con un ácido orgánico
Ácidos orgánicos: formados por carbono unido a un grupo carboxilo
Aldehídos: resultan de la unión del carbono con un grupo carbonilo, esto es, un grupo formado de un carbono y un oxígeno
Aminas: se forman por la unión del carbono a un grupo amina -NH3





Compuestos inorgánicos
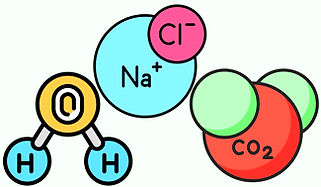
Son sustancias químicas que no contienen carbono como principal componente, a diferencia de los compuestos orgánicos
Características
-
Resultan de la combinación de los elementos metales y no metales de la tabla periódica
-
Se forman por enlaces iónicos casi siempre
-
No presentan concatenación, es decir, sus enlaces no forman cadenas
-
Algunos compuestos inorgánicos pueden formarse por enlaces covalentes, como el amoníaco, el agua y el dióxido de carbono
-
No presentan isomería, es decir, cada combinación de átomos da lugar a un único compuesto
-
Conducen corriente eléctrica en estado acuoso
-
Sus puntos de ebullición y de fusión son altos

Tipos de compuestos inorgánicos
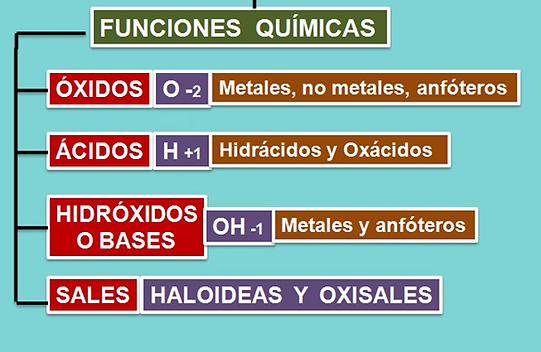
Óxidos
Reúne a los compuestos formados por la unión del oxígeno con otro elemento. Se subdividen en óxidos básicos y ácidos:
Óxidos básicos: combinan el oxígeno con un metal por medio de un enlace iónico. Por ejemplo, el óxido de magnesio (MgO), que se usa en la fabricación de antiácidos estomacales.
Óxidos ácidos: combinan el oxígeno con un no metal mediante enlaces covalentes. Por ejemplo, el monóxido de carbono (CO).
Ácidos
Surgen de la combinación del hidrógeno con elementos o grupos de alta electronegatividad. Se dividen en:
Hidrácidos: combinan hidrógeno con un no metal. Su fórmula nunca presenta oxígeno. Por ejemplo, el ácido clorhídrico (HCl).
Oxácidos: combinan agua con óxido ácido, de modo que su fórmula siempre tiene oxígeno e hidrógeno. Por ejemplo, ácido sulfúrico (H₂SO₄)
Sales
Son aquellas que resultan al combinar un ácido con una base.
Oxisal: combinan ácido oxácido y un hidróxido. Por ende, su fórmula siempre contiene oxígeno, un metal y no metal. Por ejemplo, el nitrato de sodio (NaNO3).
Sales haloideas: su estructura se compone de un no metal con un metal, y en su proceso de formación se produce agua. Por ejemplo, la sal común, cuyo nombre químico es cloruro de sodio (NaCl)
Hidróxidos
Son aquellos que se forman por combinaciones de agua con óxidos básicos. Por ello, en su estructura manifiestan la presencia de OH-. Por ejemplo, el hidróxido de sodio (NaOH), utilizado en la fabricación de textiles, crayones, pinturas y papel.
Hidruros
Suele referir a los compuestos formados por átomos de hidrógeno con cualquier elemento metal o no metal de la tabla periódica. Por ejemplo, hidruro sódico (NaH)